
|

|
|
氮,NITROGEN,源自mitron和gen,意为“硝石的形成”,1772年发现;在空气中占百分之七十八体积的气体。氮的性质并不活泼,然而它的化合物却包括麻醉用的“笑气”、TNT炸药、各种肥料以及胺基酸等──后者是蛋白质的构成基础。对于生物来说,氮是不可缺少的。 |
氮的发现简史
对大气的研究导致了氮的发现,氮的发现不是一个人做的。早在1771─1772年间,瑞典化学家舍勒(Scheele K W,1742—1786)就根据自己的实验,认识到空气是由两种彼此不同的成分组成的,即支持燃烧的“火空气”和不支持燃烧的“无效的空气”。1772年英国科学家卡文迪什(Cavendish H,1731—1810)也曾分离出氮气,他把它称为“窒息的空气”。在同一年,英国科学家普利斯特里(Priestley J,1733—1804)通过实验也得到了一种既不支持燃烧,也不能维持生命的气体,他称它为“被燃素饱和了的空气”,意思是说,因为它吸足了燃素,所以失去了支持燃烧的能力。
但是,无论是舍勒,还是卡文迪什和普利斯特里,都没有及时公布他们发现氮的结论。因此,在现在一般化学文献中,都认为氮在欧洲首先是由苏格兰医生、植物学家、化学家丹尼尔·卢瑟福(Rutherford D,1749—1819)发现的。1772年9月,丹尼尔·卢瑟福发表了一篇极有影响的论文,叫《固定空气和浊气导论》,该文原稿现保存在英国博物馆。在论文中他描述了氮气的性质,这种气体不能维持动物的生命,既不能被石灰水吸收,又不能被碱吸收,有灭火的性质,他称这种气体为“浊气”或“毒气”。这里所讲的“固定空气”即今天的二氧化碳气。
在18世纪70年代,氮并没有真正被发现和理解为一种气体化学元素。D·卢瑟福和普利斯特里、舍勒等人一样,受当时燃素说的影响,他并没有认识到“浊气”是空气的一个组成成分。浊气、被燃素饱和了的空气、窒息的空气、无效的空气等名称都没有被接受作为氮的最终名称。
氮这个名称是1787年由拉瓦锡和其他法国科学家提出的,今天的“氮”的拉丁名称Nitrogenium来自英文Nitrogen,是“硝石的组成者”的意思。化学符号为N。我国清末化学启蒙者徐寿在第一次把氮译成中文时曾写成“淡气”,意思是说,它“冲淡”了空气中的氧气。
单质氮
氮在地壳中的质量分数是0. 46%,绝大部分氮是以单质分子N2的形式存在于空气中。除了土壤中含有一些铵盐、硝酸盐外,氮以无机化合物形式存在于自然界是很少的,而氮却普遍存在于有机体中,是组成动植物体的蛋白质和核酸的重要元素。
我们从以下三个方面介绍单质氮:
1.氮的性质
2.氮的制备
3.氮的用途
氮的性质
单质氮在常况下是一种无色无臭的气体,在标准情况下的气体密度是1.25g·dm-3,熔点63K,沸点75K,临界温度为126K,它是个难于液化的气体。在水中的溶解度很小,在283K时,一体积水约可溶解0.02体积的N2。
氮气分子的分子轨道式为 ,对成键有贡献的是
,对成键有贡献的是 三对电子,即形成两个π键和一个σ键。
三对电子,即形成两个π键和一个σ键。 对成键没有贡献,成键与反键能量近似抵消,它们相当于孤电子对。由于N2分子中存在叁键N≡N,所以N2分子具有很大的稳定性,将它分解为原子需要吸收941.69kJ/mol的能量。N2分子是已知的双原子分子中最稳定的。
对成键没有贡献,成键与反键能量近似抵消,它们相当于孤电子对。由于N2分子中存在叁键N≡N,所以N2分子具有很大的稳定性,将它分解为原子需要吸收941.69kJ/mol的能量。N2分子是已知的双原子分子中最稳定的。
由氮元素的氧化态-吉布斯自由能图也可以看出,除了NH4离子外,氧化数为0的N2分子在图中曲线的最低点,这表明相对于其它氧化数的氮的化合物来讲,N2是热力学稳定状态。氧化数为0到+5之间的各种氮的化合物的值都位于HNO3和N2两点的连线(图中的虚线)的上方,因此,这些化合物在热力学上是不稳定的,容易发生歧化反应。在图中唯一的一个比N2分子值低的是NH4+离子。
由氮元素的氧化态-吉布斯自由能图和N2分子的结构均可以看出,单质N2不活泼,只有在高温高压并有催化剂存在的条件下,氮气可以和氢气反应生成氨:

在放电条件下,氮气才可以和氧气化合生成一氧化氮:

在水力发电很发达的国家,这个反应已用于生产硝酸。

N2与电离势小,而且其氮化物具有高晶格能的金属能生成离子型的氮化物。例如:

N2与金属锂在常温下就可直接反应:
6 Li + N2=== 2 Li3N
N2与碱土金属Mg 、Ca 、Sr 、Ba 在炽热的温度下作用:
3 Ca + N2=== Ca3N2
N2与硼和铝要在白热的温度才能反应:
2 B + N2=== 2 BN (大分子化合物)
N2与硅和其它族元素的单质一般要在高于1473K的温度下才能反应。
氮的制备
单质氮一般是由液态空气的分馏而制得的,常以1.5210pa的压力把氮气装在气体钢瓶中运输和使用。一般钢瓶中氮气的纯度约99.7% 。
实验室中制备少量氮气的基本原理是用适当的氧化剂将氨或铵盐氧化,最常用的是如下几种方法:
⑴加热亚硝酸胺的溶液:

⑵亚硝酸钠与氯化胺的饱和溶液相互作用:
NH4Cl + NaNO2 === NaCl + 2 H2O + N2↑
⑶将氨通过红热的氧化铜:
2 NH3+ 3 CuO === 3 Cu + 3 H2O + N2↑
⑷氨与溴水反应:
8 NH3 + 3 Br2 (aq) === 6 NH4Br + N2↑
⑸重铬酸铵加热分解:
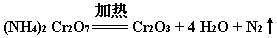
氮的用途
氮主要用于合成氨,由此制造化肥、硝酸和炸药等,氨还是合成纤维(锦纶、腈纶),合成树脂,合成橡胶等的重要原料。由于氮的化学惰性,常用作保护气体。以防止某些物体暴露于空气时被氧所氧化,用氮气填充粮仓,可使粮食不霉烂、不发芽,长期保存。液氨还可用作深度冷冻剂。
氮的成键特征和价键结构
由于单质N2在常况下异常稳定,人们常误认为氮是一种化学性质不活泼的元素。实际上相反,元素氮有很高的化学活性。N的电负性(3.04)仅次于F和O,说明它能和其它元素形成较强的键。另外单质N2分子的稳定性恰好说明N原子的活泼性。问题是目前人们还没有找到在常温常压下能使N2分子活化的最优条件。但在自然界中,植物根瘤上的一些细菌却能够在常温常压的低能量条件下,把空气中的N2转化为氮化合物,作为肥料供作物生长使用。所以固氮的研究一直是一个重要的科学研究课题。因此我们有必要详细了解氮的成键特性和价键结构。
N原子的价电子层结构为2s2p3,即有3个成单电子和一对孤电子对,以此为基础,在形成化合物时,可生成如下三种键型:
1.形成离子键
2.形成共价键
3.形成配位键
形成离子键
N原子有较高的电负性(3.04),它同电负性较低的金属,如Li(电负性0.98)、Ca(电负性1.00)、Mg(电负性1.31)等形成二元氮化物时,能够获得3个电子而形成N3-离子。
N2+ 6 Li == 2 Li3N
N2+ 3 Ca == Ca3N2
N2+ 3 Mg == Mg3N2
N3-离子的负电荷较高,半径较大(171pm),遇到水分子会强烈水解,因此的离子型化合物只能存在于干态,不会有N3-的水合离子。

形成共价键
N原子同电负性较高的非金属形成化合物时,形成如下几种共价键:
⑴N原子采取sp3杂化态,形成三个共价键,保留一对孤电子对,分子构型为三角锥型,例如NH3、NF3、NCl3等。
若形成四个共价单键,则分子构型为正四面体型,例如NH4+离子。
⑵N原子采取sp2杂化态,形成2个共价键和一个键,并保留有一对孤电子对,分子构型为角形,例如Cl—N=O 。(N原子与Cl 原子形成一个σ键和一个π键,N原子上的一对孤电子对使分子成为角形。)
若没有孤电子对时,则分子构型为三角形,例如HNO3分子或NO3-离子。硝酸分子中N原子分别与三个O原子形成三个σ键,它的π轨道上的一对电子和两个O原子的成单π电子形成一个三中心四电子的不定域π键。在硝酸根离子中,三个O原子和中心N原子之间形成一个四中心六电子的不定域大π键。
这种结构使硝酸中N原子的表观氧化数为+5,由于存在大π键,硝酸盐在常况下是足够稳定的。
⑶N原子采取sp 杂化,形成一个共价叁键,并保留有一对孤电子对,分子构型为直线形,例如N2分子和CN-中N原子的结构。
形成配位键
N原子在形成单质或化合物时,常保留有孤电子对,因此这样的单质或化合物便可作为电子对给予体,向金属离子配位。例如[Cu(NH3)4]2+。
氮的氢化物
氮的氢化物一般有:
1.氨 NH3
2.联氨 N2H4
3.羟胺 NH2OH
4.氢叠氮酸 HN3
其中最重要的是氨,它是氮的最重要化合物之一。
氨 NH3
氨是一种有刺激臭味的无色气体,我们从以下几个方面介绍氨:
⑴NH3的制备
⑵NH3分子的结构
⑶NH3的物理性质
⑷NH3的化学性质
⑸铵盐及铵盐的鉴定反应
⑴NH3的制备
工业上制备氨是用氮气和氢气在高温高压和催化剂存在下直接反应合成的:

实验室中通常用铵盐和强碱的反应来制备少量氨气:
(NH4)2SO4 (s) + CaO (s) === CaSO4 (s) + 2 NH3↑+ H2O
有些铵盐(如NH4NO3、(NH4)2 Cr2O7等)受热分解可能产生氮气或氮的氧化物,所以一般用非氧化性酸的铵盐(如NH4Cl)实验室中另一种制备氨的方法是用氮化物同水作用:
Mg3N2 + 6 H2O === 3 Mg(OH)2 + 2 NH3↑
⑵NH3分子的结构
在NH3分子中,N原子采取不等性sp3杂化,有一对孤电子对和三个与H原子结合成的共价单键。由于孤电子对对成键电子对的排斥作用,使N桯键之间的键角∠HNH 不是正四面体的109°28’,而是107°分子形状是三角锥状的。这种结构使得NH3分子有相当大的极性(偶极距为5.5×10-30C·m),易形成氢键。
⑶NH3的物理性质
NH3极易溶于水,在水中的溶解度比所有其它气体都大。273K时1dm3水能溶解1200dm3的氨。通常把溶有氨的水溶液叫做氨水。一般市售浓氨水的密度是0.91gcm-3,含NH3约28%NH3在常温下很容易被加压液化,液氨是一个很好的溶剂,由于分子的极性和存在氢键,液氨在许多物理性质方面同水非常相似(见表二液氨和水的物理性质)。

NH3和H2O相比,它们的差别在于:
① NH3是比H2O更强的亲质子试剂,或者说更好的电子对给予体。
② NH3放出质子H+的倾向弱于H2O分子。
一些活泼的金属可以从水中置换氢和生成氢氧化物,在液氨中就不那么容易置换氢。但液氨能够溶解金属生成一种蓝色溶液。这种金属液氨溶液能够导电,并缓慢分解放出氢气,有强还原性。例如钠的液氨溶液:

金属液氨溶液显蓝色,能导电并有强还原性的原因是因为在溶液中生成“氨合电子”的缘故。例如金属钠溶解在液氨中时失去它的价电子生成正电子:

然后液氨分子同离子和电子发生溶剂加合作用:

⑷NH3的化学性质
NH3的主要化学性质有以下几个方面:
①易形成配合物
NH3分子中的孤电子对倾向于和别的分子或离子形成配位键,生成各种形式的氨合物。如[Ag(NH3)2]+、[Cu(NH3)4]2+、BF3·NH3等都是以NH3为配位的配合物。
②弱碱性
NH3极易溶于水,在水中主要形成水合分子NH3H2O和2NH3H2O。在这些水合物中既不存在NH4+和OH-,也不存在NH4OH分子,它们是氨分子通过氢键(键长为276pm)同水分子相连接的。在298K时,0.1moldm-3 NH3水溶液中只有1.34%发生电离作用:

上述反应的平衡常数表示式是:

所以NH3水溶液显弱碱性。
NH3和氯化氢HCl在气态或水溶液中都能直接化合生成氯化铵NH4Cl :
NH3 + HCl ==== NH4Cl
NH3和其它酸作用也同样得到相应的铵盐。
③还原性
NH3分子和NH4+离子中N的氧化数为-3,因此在一定条件下它们能失去电子而显还原性。例如:
i.氨在空气中不能燃烧,却能在纯氧中燃烧:
4 NH3+ 3 O2 === 6 H2O + 2 N2
在催化剂(铂网)的作用下,NH3可被氧化成NO:
4NH3+5 O2 === 4 NO + 6 H2O
这个反应是工业合成硝酸的基础。
ii.Cl2或Br2在常温下,也能在气态或溶液中把NH3氧化成单质:
2 N H3+ 3 Cl2 === 6 HCl + N2
若Cl2过量,则生成 NCl3
NH3+ 3 Cl2 === NCl3 + 3 HCl
iii.NH3通过热的CuO可以被氧化成单质N2:
2 NH3+ 3 CuO === 3 Cu + 3 H2O + N2
氨与过氧化氢或高锰酸盐作用,也均可被氧化成单质氮:

iv.NH4+离子的还原性比NH3分子更为明显,许多有氧化性含氧酸的铵盐,受热会发生激烈反应,其中N3-被氧化成N2或其它氮的氧化物。如:

热的HNO3和HCl 的混合物可以将溶液中的铵离子完全氧化成氮或氮的氧化物。为了消除溶液中的NH4+离子时,这个反应是非常有用的。
⑸铵盐及铵盐的鉴定反应
①铵盐一般是无色的晶体,易溶于水。NH4+和Na+是等电子体,因此NH4+具有+1价金属离子的性质。NH4+离子有较大的半径148pm ,近似于K+133pm、Rb+148pm离子的半径,所以铵盐常与钾盐、铷盐同晶,并有相似的溶解度。
②由于氨的弱碱性,铵盐都有一定程度的水解,由强酸组成的铵盐,其水溶液显酸性:
NH4Cl + H2O ==== NH3·H2O + HCl
③在任何铵盐的溶液中加入强碱并加热,就会释放出NH3,这是检验是否是铵盐的反应。

铵盐的另一种鉴定方法是向含有NH4+的溶液中加入奈斯勒试剂,即能产生特征的红褐色沉淀:

(奈斯勒试剂是[HgI4]2-与KOH的混合溶液)
④铵盐的一个重要性质是它的热稳定性差,固态铵盐加热易分解为氨和相应的酸:

如果酸是不挥发性的,则只有氨挥发逸出,而酸或酸式盐则残留在容器中:

如果相应的酸有氧化性,则分解出来的NH3会立即被氧化,例如NH4NO3受热分解时,NH3被氧化成N2O:

如果加热温度高于573K时,N2O又分解为N2和O2:

由于这些化合物分解时产生大量的热,分解产物是气体,所以如果在密闭的容器中进行就会发生爆炸。基于这个性质,NH4NO3可用于制造炸药。
联氨 N2H4
联氨NH2-NH2又叫“肼”,可以看成是NH3分子内的一个H原子被氨基 -NH2取代的衍生物,分子结构如下图所示:

联氨的结构类似于过氧化氢H2O2,根据联氨分子具有很大极性( )这一事实,说明它是顺式结构。在N2H4中每个N原子上都有一对σ孤电子对,N的氧化数为-2。
)这一事实,说明它是顺式结构。在N2H4中每个N原子上都有一对σ孤电子对,N的氧化数为-2。
联氨的制备方法是用次氯酸钠NaClO溶液氧化过量的NH3,总的反应:
NaClO + 2 NH3 === N2H4 + NaCl + H2O
N2H4是一种无色的高度吸湿性的可燃液体,在N2H4中N原子的孤电子对可以同H+结合而显碱性,但其碱性不如NH3强,N2H4是一个二元弱碱。
N2H4和NH3一样也能生成配位化合物。
在碱性溶液中,N2H4是个强还原剂,它能将AgNO3还原成单质银,它也可以被卤素氧化:
N2H4+ 2 X2=== 4 HX + N2
N2H4在空气中燃烧或与过氧化氢H2O2反应时,都能放出大量的热,因此可用作火箭燃料,做火箭的推进剂:

羟胺 NH2OH
羟胺 NH2OH可以看作是NH3分子内的一个H原子被羟基-OH取代的衍生物,它的分子结构如下图所示:

分子中N原子的氧化数为-1,N原子上有一对孤电子对。和联氨一样,羟胺是一种比联氨还弱的碱。由于孤电子对的存在,羟胺也可以作为配位体,生成配位化合物。
纯羟胺是一种不稳定的白色固体。在碱性溶液中羟胺是个较强的还原剂,例如它能把银盐还原成单质银:
2 NH2OH + 2 AgBr === 2 Ag + N2 + 2 HBr+ 2 H2O
2NH2OH + 4 AgBr === 4 Ag + N2O +4 HBr +H2O
联氨或羟胺作还原剂的优点,一方面是它们有强还原性,另一方面是它们的氧化产物可以脱离反应系统,不会给反应溶液里带来杂质。
氢叠氮酸 HN3
联氨被亚硝酸氧化时便可生成氢叠氮酸HN3:
N2H4 + HNO2 ==== 2 H2O + HN3
它的分子结构如下图所示:

在HN3分子中,三个N原子以直线相连,H-N键与N-N-N键间的夹角为110.9°,显然靠近H原子的第1个N原子是sp2杂化的,第2和第3个N原子都是sp杂化的,在三个N原子间存在着离域的 大π键。HN3中N原子的平均氧化数为-1/3 。N3-离子是一个似卤离子,反应性能类似于卤离子,例如AgN3也是难溶于水的。
大π键。HN3中N原子的平均氧化数为-1/3 。N3-离子是一个似卤离子,反应性能类似于卤离子,例如AgN3也是难溶于水的。
纯HN3是无色液体,是一种爆炸物,受热或受撞击就爆炸,常用于引爆剂。HN3在水溶液中是稳定的,在水中略有电离,它的酸性类似于醋酸,是个弱酸。
氮的氧化物
N原子和O原子可以有多种形式结合,在这些结合形式中,N的氧化数可以从+1变到+5。在五种常见的氮的氧化物中,以一氧化氮NO和二氧化氮NO2较为重要。
1.一氧化氮NO
2.二氧化氮NO2
3.一氧化二氮N2O
4.三氧化二氮N2O3
5.五氧化二氮N2O5
一氧化氮NO
在NO分子中,N原子采取sp 杂化,形成一个σ键,一个π键和一个三电子π键。N的氧化数为+2。NO共有11个价电子,全部成对是不可能的,因此NO是一个奇电子分子,是顺磁性的。
NO是一种无色气体,微溶于水但不与水反应,不助燃,常温下与氧立即反应生成红棕色的NO2:
2 NO + O2 ==== 2 NO2
由于分子中有孤电子对,易与卤素加合反应生成卤化亚硝酰:
2 NO + Cl2=== 2 NOCl
NO也可以作为配体与过渡金属离子生成配位化合物,它与Fe2+生成的亚硝酰合物,是检验硝酸根的“棕色环实验”显色的原因:
NO + FeSO4 ==== [Fe(NO)]SO4
NO是一种中性氧化物而不是一种酸酐。
实验室中制备NO的方法是用铜与稀硝酸反应:
3 Cu + 8 HNO3(稀) === 3 Cu(NO3)2+ 2 NO↑+ 4 H2O
二氧化氮NO2
在NO2分子中,N原子采取sp2杂化,形成两个σ键,一个三电子π键,N的氧化数为+4,分子构型为角形。NO2共有17个价电子,是一个奇电子分子,是顺磁性的。
NO2是一种红棕色有毒的气体,低温时易聚合成无色的N2O4:
2 NO2 ==== N2O4
NO2易溶于水或碱中生成硝酸和亚硝酸或硝酸盐和亚硝酸盐的混合物,是一种混合酸酐:
2 NO2 + H2O == HNO3 + HNO2
2 NO2 + 2 NaOH === NaNO3 + NaNO2 + H2O
将NO氧化或用铜与浓HNO3反应均可制备出NO2:
2 NO + O2 ==== 2 NO2
Cu + 4 HNO3(浓) === Cu(NO3)2 + 2 NO2↑+ 2 H2O
一氧化二氮N2O
N2O是一种无色气体,有甜味儿,能溶于水,但不与水作用。能助燃,是一种中性氧化物,常被用作麻醉剂。
N2O的分子是直线形的,N原子采取sp杂化,生成两个σ键,两个三中心四电子π键,N的氧化数为+1。
硝酸铵加热分解可制备出N2O:

三氧化二氮N2O3
N2O3是不稳定的蓝色气体,将NO和NO2缩合在一起就可以得到N2O3:
NO (无色) + NO2 (红棕色) ==== N2O3 (蓝色)
常压下N2O3即可分解为NO和NO2。N2O3是一个酸性氧化物,它是亚硝酸的酸酐。
N2O3分子的结构如图所示:

在分子中N原子都采取sp2杂化,两个N原子通过σ共价键相连,在整个分子中存在着一个五中心六电子的离域的大π键 。N的氧化数为+3。
。N的氧化数为+3。
五氧化二氮N2O5
N2O5是一种白色固体,易潮解,极不稳定,能爆炸性分解,分解为NO2和O2,是个强氧化剂,溶于水生成硝酸,它是硝酸的酸酐。

N2O5可用P2O5使HNO3脱水或用NO2与臭氧O3反应来制备:
N2O5分子在气相中结构:N原子以sp2杂化成键,6个σ键,2个三中心四电子π键 。
。
亚硝酸及其盐
关于亚硝酸及其盐,我们讨论:
1.亚硝酸的制备
2.亚硝酸的结构
3.亚硝酸及其盐的性质
4.亚硝酸根离子的鉴定
亚硝酸的制备
把等摩的NO和NO2的混合物溶解在冰冻的水中或者向亚硝酸盐的冷溶液中加入强酸时,都可以在溶液中生成亚硝酸:

HNO2很不稳定,仅存在于冷的稀溶液中,微热甚至冷时便会分解成NO、NO2和H2O。
亚硝酸的结构
在HNO2分子中,N原子采取sp2杂化,生成两个σ键,一个π键,还有一对孤电子对,NO2-离子为平面三角形结构,N的氧化数为+3。
HNO2有两种结构:顺式和反式,一般来讲,反式结构比顺式稳定。
亚硝酸及其盐的性质
⑴HNO2是个弱酸,但酸性比醋酸略强:

⑵氧化性
亚硝酸及其盐中N原子具有中间氧化态+3,虽然它们既具有氧化性,又具有还原性,但以氧化性为主。而且它的氧化能力在稀溶液时比NO3-离子还强,这一点从它们在酸性溶液中的标准电极电势值可以看出:
⑶还原性
虽然在酸性溶液中HNO2是个较强的氧化剂,但遇到比它氧化性更强的KMnO4、Cl2等强氧化剂时,它也可以表现出还原性,被氧化为硝酸盐:

在碱性溶液中NO2-的还原性是主要的,空气中的氧就能把NO2-氧化成NO3-。
⑷NO2-离子易生成配位化合物

⑸亚硝酸盐具有很高的热稳定性,可用金属在高温下还原硝酸盐的方法来制备亚硝酸盐:
Pb(粉)+NaNO3====PbO + NaNO2
亚硝酸盐除黄色的AgNO2不溶于水外,一般都易溶于水,亚硝酸盐有毒,是致癌物质。
亚硝酸根离子的鉴定
在酸性溶液中,NO2-与对胺基苯磺酸和-萘胺作用,生成有特征浅粉红色的溶液,证明NO2-离子的存在:

这个反应用来检验低浓度的NO2-离子,当NO2-浓度增大时,粉红色消失,生成黄色溶液或褐色沉淀。
硝酸及其盐
硝酸是重要的工业三酸之一,它是制造炸药、染料、硝酸盐和许多其它化学药品的重要原料,我们讨论:
1.硝酸的制备方法
2.硝酸分子的结构
3.硝酸的强氧化性
4.硝酸盐的热不稳定性
5.硝酸根离子的鉴定
硝酸的制备方法
⑴氨催化氧化法
氨催化氧化法是目前主要的工业制造硝酸的方法。在1273K和铂网(90%Pt,10%Rh合金网)为催化剂时,NH3可以被空气中的O2氧化成NO,NO进一步与O2作用生成NO2,NO2被水吸收就成为硝酸:

用这个方法制得的硝酸溶液含HNO3约50% ,若要得到更高浓度的酸,可在稀HNO3中加浓H2SO4作为吸水剂,然后蒸馏。
硝酸不稳定,受热或受光照射会慢慢发生分解作用:
4HNO3 === 2H2O + NO2 + O2
⑵电弧法
让空气通过温度为4273K的电弧,然后将混合气体迅速冷却到1473 K以下,可以得到NO气体:

进一步冷却,并使得NO与O2作用变成NO2,然后用水吸收制成硝酸。此方法受电力资源的限制。
在自然界里,雷电把空气里一部分N2和O2结合在一起,生成氮的氧化物被雨水吸收成硝酸而淋入土壤中,再和沙石土壤化合成硝酸盐或其它含氮化合物,经植物吸收而变成有机氮化合物棗蛋白质等。这种过程与植物通过根瘤菌把空气中的氮固定为氮化合物的过程一起维持着氮素在自然界的循环。
⑶硝酸盐与浓硫酸作用法
在实验室中,用硝酸盐与浓硫酸反应来制备少量硝酸,此法过去曾用于工业生产上。

由于HNO3是一个挥发性酸,可以从反应混合物中蒸馏出来。在这个反应中只能利用H2SO4中的一个氢,因为第二步反应:

需要在773K左右反应,此时HNO3会分解,反而使产率降低。
硝酸分子的结构
在HNO3分子中,N原子采取sp2杂化,形成三个σ键,三个O原子围绕N原子在同一平面上成三角形状。
N原子π轨道上的一对电子和两个O原子的成单π电子形成一个垂直于sp2平面的三中心四电子的不定域π键,N原子的表观氧化数为+5。
在NO3-中,每个∠ONO键角是120°,N原子仍是sp2杂化,除形成三个σ键外,还与三个O原子形成一个π键。
硝酸的强氧化性
强氧化性是硝酸的一个重要化学性质,我们从
⑴反应机理
⑵与金属反应
⑶与非金属反应
三个方面讨论硝酸的强氧化性。
反应机理
硝酸的强氧化性是由于:
①HNO3中的N处于最高氧化态+5。
② HNO3分子不稳定,受光照射时会分解放出O2和NO2:

分解出的NO2对反应有催化作用,HNO3获得还原剂的电子,反应便被加速:

Cu和HNO3反应,最初速率很慢,随后逐渐加快,若向溶液中加入NaNO2晶体,可加快Cu与HNO3的反应。另外,发烟HNO3有很强的氧化性,就是因为在酸中溶解有很多的NO2的缘故。这些事实就是NO2有催化作用的证据。
金属反应
除少数金属(金、铂、铱、铑、钌、钛、铌等)外,HNO3几乎可以氧化所有金属生成硝酸盐。例如:

(铁、铝、铬等与冷的浓HNO3接触时会被钝化,所以现在一般用铝制容器来装盛浓HNO3。)
稀HNO3也有较强的氧化能力,与浓HNO3不同之处在于稀HNO3的反应速度慢,氧化能力较弱,被氧化的物质不能达到最高氧化态,例如Hg22+

浓HNO3作为氧化剂时,其还原产物多数为NO2。硝酸与金属反应,其还原产物中N的氧化数降低多少,主要取决于酸的浓度、金属的活泼性和反应的温度,反应复杂,往往同时生成多种还原产物。
与非金属反应
非金属中除Cl2、O2、稀有气体外,都能被浓HNO3氧化成氧化物或含氧酸,例如:

有机物或碳能被浓HNO3氧化成CO2,有些有机物遇到浓HNO3甚至可以燃烧。浓HNO3与非金属作用时的还原产物往往是NO。
硝酸盐的热不稳定性
硝酸盐的热稳定性不如亚硝酸盐,硝酸盐受热易分解,硝酸盐的热分解情况复杂,主要分为以下几种:
⑴碱金属和碱土金属的无水硝酸盐热分解生成亚硝酸盐和放出O2气:

⑵电位顺序在Mg与Cu之间的金属元素的无水硝酸盐热分解时生成相应金属的氧化物,如:

(电位顺序:K Na Mg Zn Fe Ni Sn Pb H Cu Hg Ag Au)
⑶硝酸盐的阳离子如果有氧化能力或还原能力时,它们的无水硝酸盐受热分解时,可能发生阴阳离子之间的氧化还原反应,例如:

⑷含有结晶水的硝酸盐受热分解时会发生水解反应,生成碱式盐。因为HNO3是个易挥发性酸。

硝酸根离子的鉴定
在试管中加入少许硝酸盐的稀溶液,再加入少许Fe2+的酸性溶液,然后沿试管壁加入浓硫酸,则在浓硫酸和试液的界面上可以形成一棕色环,此棕色环可证明NO3-存在。

 收藏此帖
收藏此帖 收藏此帖
收藏此帖