1.空气
是混合物,组成:N2 78%,O2 21%,稀有气体 0.94%,CO2 0.03%,水蒸气和灰尘 0.03%。
平均相对分子质量:29;密度:1.29 g / L。
性质:无色、无味气体,加压、降温可转变成淡蓝色液体,还可变成淡蓝色雪花状固体。
2.稀有气体
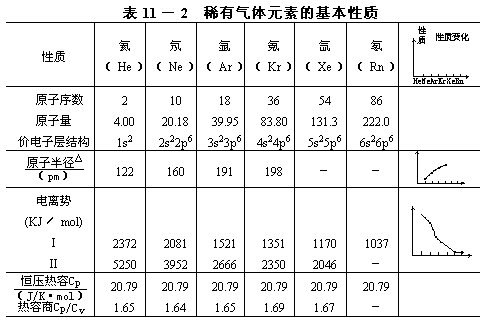
位置:0族。
结构:He为2电子结构,其余为8电子结构。单原子分子,属于分子晶体。其原子半径在短周期中比碱金属大,在长周期中比碱金属小。
性质:无色、无味气体,难溶于水,熔、沸点低。化学性质一般不活泼。
用途:① 作保护气(Ar用于电弧焊,Ar、He混合气充入灯泡);② 作电光源(发有色光和强光);③He和O2混合制人造空气,潜水用;He充气球、气艇,原子反应堆中作冷却剂;④Ne、Kr、Xe用于激光,Xe作麻醉剂。
3.水
组成:H2O。氢氧的物质的量之比为2∶1,质量比为1∶8。
结构:极性键,极性分子,键角:104.5°。
性质;稳定。
水化、水合、水解。
水作催化剂。在许多反应中,水可催化剂,如在非常干燥的情况下,氯气和金属不能化合;氟化氢不能腐蚀玻璃;爆呜气在加热到1000℃时还不爆炸。平常这些反应都能迅速进行,这是微量水蒸气存在的缘故;又如滴水生紫烟:2Al+3I2 2AlI3+Q。
水作氧化剂、作还原剂,既作氧化剂又作还原剂,既不作氧化剂又不作还原剂。
水是极弱的电解质,在常温下,1 L (55.6 mol) 水中有1×10-7 mol水分子发生电离,电离度为1.8×10-7%,水的离子积为1×10-14,100℃时,水的离子积为1×10-12。
4℃时,水的密度最小,为1 g / cm3。
水的净化和水的软化:水的净化是指除去水中混有的杂质,如用过滤除去泥沙,用净水剂明矾使水中的胶体颗粒凝聚而除去。这是物理法。(除悬浮杂质)水的软化是用化学方法除去水中的Ca2+、Mg2+,是水净化的深入。二者都是提高水质的重要手段。
例1.取适量干燥的锌粉和碘粉,小心地混和后未观察到明显的现象,当滴加少量水后,则有紫色气体出现,由此可得出结论__________________。(1991年西安市竞赛题)
答案:水是催化剂。
例2.取2 g干燥铝粉和3 g碘粉小心混匀,分为四堆,往堆上分别各加0.5 g水,1 g明矾,1 g胆矾,1 g无水CuSO4。加水那堆首先冒火花,发生剧烈反应,其次发生反应的是加明矾的那一堆;再次是加胆矾的发生反应,而加无水CuSO4的那一堆最难发生反应。
① 铝和碘反应的化学方程式为________________________________,
② 铝和碘反应还可以看到____________________________________,
③ 四堆混和物发生反应的先后顺序说明________________________。
(1987年全国竞赛题)
答案:⑴ 2Al+3I2 2AlI3
⑵ 紫色蒸气
⑶ 水是催化剂,明矾比蓝矾易失水
例3.非金属卤化物能剧烈地发生水解反应,如:PBr3+3H2O =H3PO3+3HBr↑。有人利用此反应原理制备少量的碘化氢。制备时直接把水逐滴地滴在磷和碘的混合物上即可连续地产生HI。试写出此反应的化学方程式:_______________________________________。
答案:2P+3I2+6H2O =2H3PO3+6HI↑
4.氢气 H2
(1)天然氢元素中,2H占0.015%,1H占99.985%。一吨海水中就有30 g氘。1 kg氘和氚发生聚变反应时放出的能量,比相同重量的铀的裂变能高8倍以上。地球上的海水有1.37×1018 t,其中含氘约30万亿吨,顶得上三万亿亿吨优质煤,即便是以后全世界的能源消耗比现在高一百倍,那也够人类享用几亿年。
(2)物理性质:无色无嗅气体,密度最小(0.899 g / L),沸点很低,难溶于水。
(3)化学性质:
可燃性:2H2+O2 2H2O(氢、氧混合点火会爆炸,在空气中混入4—7.2%体积的氢, 是爆炸极限。两体积氢和一体积氧的混合气体叫“爆呜气”。)
还原性:加热时表现还原性,可作还原剂。
3H+WO3 W+3H2O H2+CuO Cu+H2O
与非金属形成气态氢化物:
2H2+Br2 2HBr
氢气与非金属单质反应:即使在温度低到-250℃时,H2也能同液态F2或固体单质F2反应。在低温下,H2与其它单质卤素或O2不发生反应。在暗处,H2和Br2的混合物要在高于400℃才会发生爆炸性化合反应;H2和I2要在500℃以上才发生反应。H2与S或Se在250℃时直接化合。H2与N2仅在有催化剂存在时才发生反应。引发电弧时,石墨电极与H2可直接生成烃类。
非金属气态氢化物极性共价化合物,一般具有还原性;在周期表中ⅥA—ⅦA除水外,其余的水溶液为酸。
非金属气态氢化物的稳定性
HF、H2O加热到2000℃也不分解,HCl加热到2000℃时也只有0.8%分解,600K时HCl有1.5×10-6 %分解,HBr有10-3 %分解,HI有19%分解。
在1000℃时分解百分率 分解温度
HF 不分解 H2O 1000℃很难分解
HCl 0.014% H2S 300℃
HBr 0.5% H2Se 250℃
HI 33% H2Te 0℃
氢气与金属氧化物反应
Mn和活泼性顺序中Mn以后的金属氧化物,都可以在加热下被H2还原,由高价氧化物还原成低价氧化物,最后还原成金属。例如:
3Fe2O3+H2 2Fe3O4+H2O <325℃
Fe2O3+3H2 2Fe+3H2O >325℃
Fe3O4+4H2 3Fe+4H2O >325℃
上述反应证明H2比CO或CO+H2是Fe2O3更有效的还原剂。
金属固态氢化物是离子化合物,氢为-1价。能与水反应产生氢气,如CaH2是野外制氢的好材料。CaH2+2H2O=Ca(OH)2+H2。
例1.对于反应H-+NH3 =H2+ 的正确说法是 ( BD )
A. 属于置换反应 B. H-是还原剂
C. NH3是还原剂 D. 氧化产物和还原产物都是H-
(4)氢的特殊性:
氢原子核外只有1个电子,只有一个电子层。
普通氢原子核内无中子。
氢离子没有电子,相当于裸露的质子。
氢原子半径最小的。
氢最轻的元素,氢气的密度最小,是最轻的气体。
氢负离子是唯一一个带负电荷的氦型离子。
(5)氢气的制取
实验室里制取氢气,采用不纯的锌粒与稀硫酸或稀盐酸反应来制取。
Zn+2HCl=ZnCl2+H2
Zn+H2SO4=ZnSO4+H2
如果用铝跟氢氧化钠溶液反应制得较纯的氢气。
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
在野外还可以用金属氢化物与水反应来快速生氢。
CaH2+2H2O=Ca(OH)2+2H2↑
可用启普发生器制取氢气,用排水法或向下排空气法收集氢气。
 收藏此帖
收藏此帖